订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com
一、 核心发现:SARM1作为新型DNA传感器的颠覆性角色
传统上,SARM1(Sterile alpha and TIR motif containing 1)被认为主要在神经元中响应代谢压力(如NAD+前体失衡)而激活,通过降解关键的细胞代谢物NAD+来执行轴突变性。
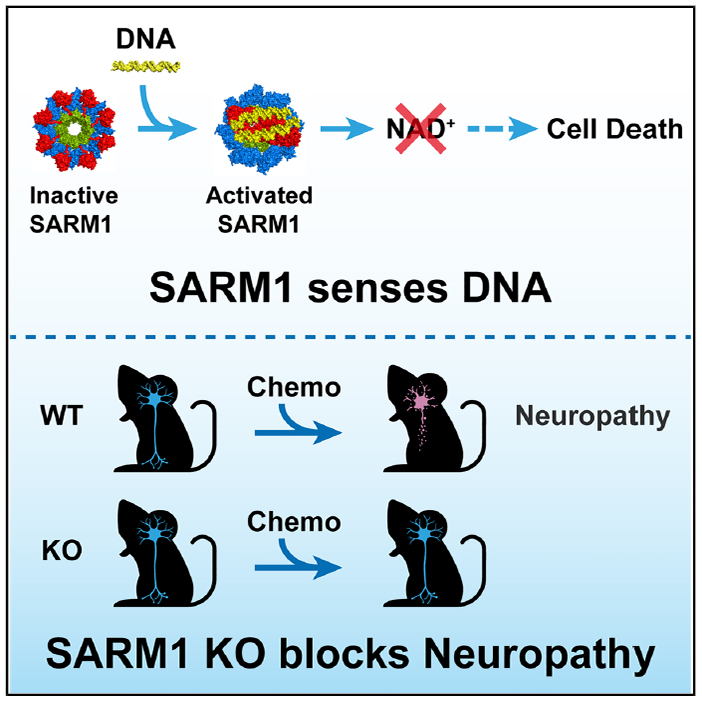
本研究颠覆了这一认知,发现SARM1能够直接结合细胞质中的双链DNA(dsDNA),并将其作为一种“危险信号”。一旦结合,SARM1便被激活,大量降解NAD+,最终导致细胞死亡。这种机制使SARM1成为一个新型的、不依赖于序列的DNA传感器,其功能类似于著名的cGAS-STING通路,但下游效应是NAD+降解而非干扰素产生。
二、 关键机制解析
1. dsDNA直接激活SARM1的NAD+酶活性
研究人员通过体外生化实验证实,将纯化的SARM1蛋白与dsDNA和NAD+共同孵育,会显著促进其催化产物cADPR(环腺苷二磷酸核糖)的生成,同时消耗NAD+。这种激活是长度依赖性的(需要≥45 bp的dsDNA),但不依赖于DNA的特定序列。
2. SARM1通过其TIR结构域直接结合dsDNA
为了确定SARM1如何识别dsDNA,研究团队系统性地测试了其各个结构域(ARM, SAM, TIR)的结合能力。
实验方法:使用电泳迁移率变动分析(EMSA)、微量热泳动(MST)和荧光淬灭实验。
关键发现:TIR结构域是负责结合dsDNA的关键区域。进一步的点突变实验表明,TIR结构域中的三个赖氨酸残基(K602, K628, K636)对DNA结合至关重要,将它们突变为谷氨酸(3KE突变体)会完全废除结合能力。
3. 独特的“双DNA夹心”激活模型
通过结构生物学(冷冻电镜)和生物物理(ITC, SEC)分析,研究人员提出了一个创新的SARM1激活模型:
SARM1以八聚体形式存在。
两个dsDNA分子像“三明治”一样被夹在两个SARM1八聚体之间,形成 SARM1八聚体₂–dsDNA₂的复合物结构。
这种特殊的空间排布可能促使SARM1的TIR结构域发生构象变化,从自抑制状态转变为激活状态。
三、 细胞生物学功能验证
1. 外源dsDNA触发SARM1依赖的细胞死亡
在细胞实验中,将dsDNA转染进表达SARM1的HEK293T细胞后:
可观察到SARM1与转染的dsDNA在细胞质共定位。
导致NAD+水平急剧下降。
最终引发细胞死亡。
这种死亡效应在SARM1敲除(KO)或DNA结合缺陷突变体(3KE)的细胞中被完全消除,证明该过程是SARM1特异性的。
2. 作为化疗诱导神经病变(CIN)的关键介质
许多化疗药物(如奥沙利铂)会损伤DNA,导致细胞质中积累异常DNA。本研究揭示了SARM1在此过程中的核心作用:
化疗药物处理的细胞中,SARM1与胞质DNA共定位并被激活。
在小鼠模型中,敲除SARM1或其DNA结合能力(3KE突变),能显著减轻化疗药物引起的神经毒性症状(如后肢蜷缩、机械性痛觉过敏)。
四、 总结与深远意义
这项研究的主要贡献和意义可总结如下:
发现新功能: 首次鉴定SARM1为一个新型的、不依赖序列的胞质DNA传感器,极大地扩展了我们对SARM1生物学功能的理解。
阐明新机制: 揭示了SARM1通过其TIR结构域直接结合dsDNA,并提出了独特的 “双DNA夹心”激活模型。
连接病理过程: 将SARM1的DNA感知功能与化疗诱导的神经病变(CIN)这一重要临床问题直接联系起来,为理解其发病机制提供了全新视角。
开辟治疗新途径: 表明靶向SARM1的DNA结合界面(而非其酶活中心)可能成为一种更特异、更安全的新策略,用于预防或治疗化疗等引起的神经毒性,同时避免干扰细胞正常的NAD+代谢。
总之,这项工作不仅重新定义了SARM1在先天免疫中的作用,也为干预一系列由DNA异常触发的病理过程(从病毒感染到化疗副作用)提供了全新的潜在靶点。
Wang, L. et al. SARM1 senses dsDNA to promote NAD(+) degradation and cell death. Cell S0092-8674(25)01126–2 (2025) doi:10.1016/j.cell.2025.09.026.












