订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com
一、 研究背景与核心问题
基因组编辑技术(如CRISPR-Cas)的革命极大促进了功能基因组学和基因治疗的发展。然而,现有技术存在两大瓶颈:
尺度限制:CRISPR系统依赖于同源定向修复(HDR)或先导编辑(Prime Editing),难以高效地插入、删除或倒转超过几十个碱基的大片段DNA。
疤痕问题:传统的位点特异性重组酶(如Cre-LoxP)虽然能处理大片段,但需要在基因组中预装识别位点,编辑后会留下“疤痕”序列,且缺乏可编程性。
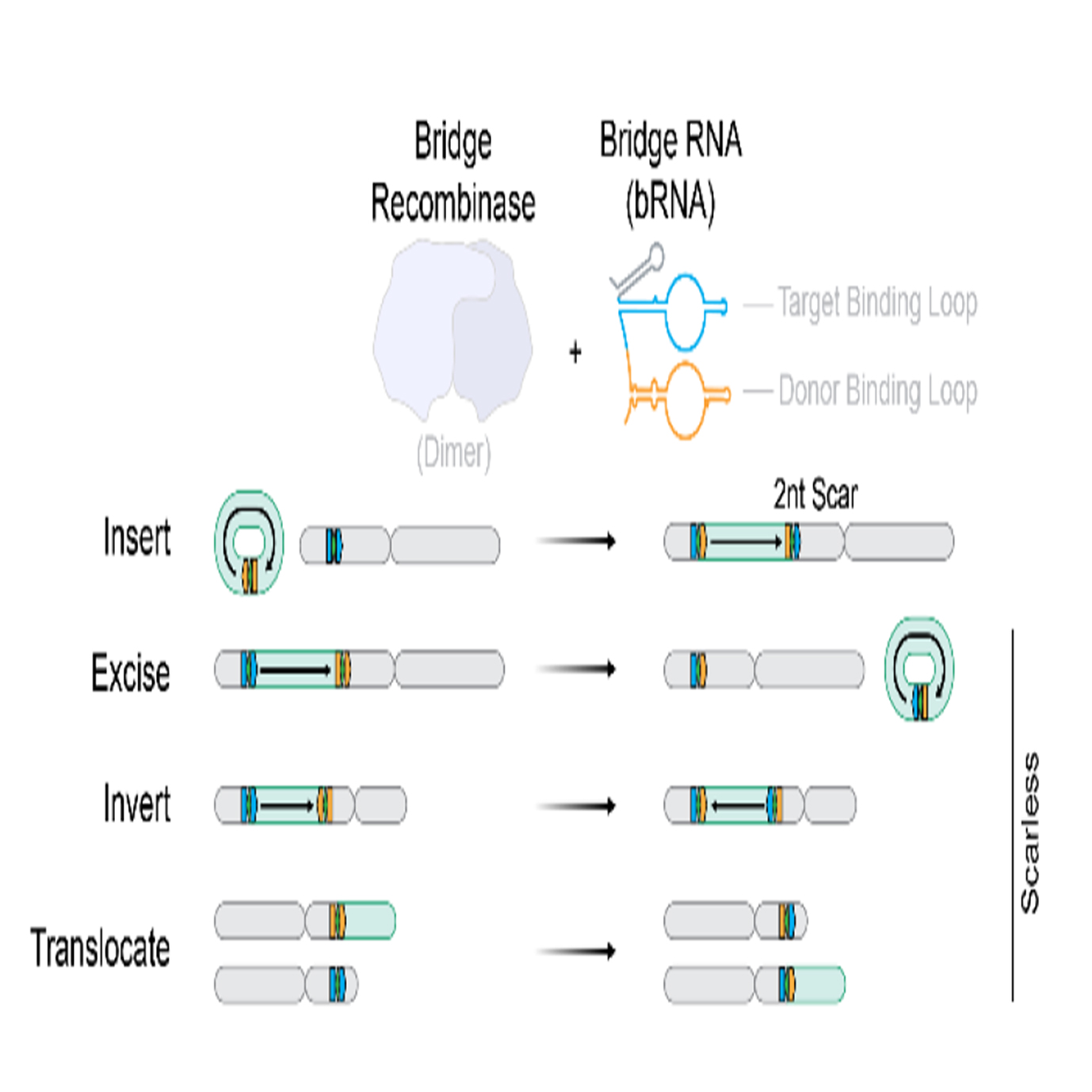
Bridge重组酶(源自IS110转座子家族)的出现有望解决这些问题。它通过一种独特的桥RNA(bridge RNA, bRNA)同时识别目标DNA(Target)和供体DNA(Donor)序列,指导重组酶进行精准的切割与重连,理论上可实现任何序列的无缝编辑。然而,其此前仅在原核系统(如大肠杆菌)中得到验证。
本研究的核心目标即是:发现并改造一种能在人类细胞中高效工作的Bridge重组酶系统,并系统评估其编程人类基因组的能力。
二、 核心发现与成果
1. 发现高效人类细胞Bridge重组酶:ISCro4
研究团队从其庞大的IS110元件库中筛选了72个候选Bridge重组酶,通过在人类细胞(HEK293FT)中测试其介导DNA倒转的报告系统活性,发现了一个名为 ISCro4(来源于Citrobacter rodentium)的ortholog活性显著高于其他候选。
关键数据:在报告系统中,ISCro4的活性比其他测试的ortholog高出4倍以上,是唯一一个在荧光素酶报告系统中检测到显著信号的酶。
结构基础:通过AlphaFold 3建模,证实ISCro4与先前解析的IS621结构高度相似(RMSD=2.5Å),其bRNA通过目标结合环(TBL)和供体结合环(DBL)分别识别14bp的目标和供体序列,围绕一个二核苷酸核心(CT/GT)进行保守重组。
2. 理性设计并大幅增强bRNA活性
基于结构信息,研究人员对bRNA进行了系统的工程化改造,这是本研究的核心创新点之一。
拆分bRNA:发现将完整的bRNA拆分为独立的TBL和DBL RNA分子(split bRNA)时,重组效率反而比单链bRNA提高了约2.1倍。这印证了之前的结构研究推测——功能性重组酶复合体是四聚体,可能由两个独立的bRNA分子参与组成。
关键优化:
去除 linker:发现连接TBL和DBL的linker区域是抑制活性的关键,去除后活性显著提升。
稳定茎环结构:延长DBL的茎环结构(+6 bp或+11 bp)能分别带来1.3和1.4倍的活性提升。
点突变:在TBL中引入稳定性的点突变(如A87G, A61G+U73C)或删除不必要的未配对碱基(dU86, dU88),能进一步提升活性。
增强型bRNA:将优化后的TBL4和DBL3组合,并通过一个GC二核苷酸linker连接,构建了增强型单链bRNA。该bRNA在单链形式下比野生型(WT)活性提高3.8倍,而在最优的split形式(TBL4 + DBL3)下,比WT活性提高了惊人的6.4倍。
3. 揭示机制并解决特异性难题:DBL靶向基因组
在应用ISCro4进行基因组插入时,研究团队发现了一个出乎意料的现象:绝大多数(91.3%)的插入事件发生在与供体序列(DBL指定)相似的基因组位点,而非预期的目标序列(TBL指定)。
机制阐释:这与Bridge重组酶的作用机制有关。研究发现,重组酶复合体可以由两个DBL(而非一TBL一DBL)组成,从而介导“供体-供体”型重组(DBL-DBL recombination)。
解决方案:为解决这一问题,研究团队提出了一个关键策略:让DBL结合基因组,而让TBL结合供体质粒。同时,在供体质粒上使用一个基因组中不存在的“正交序列”。
卓越成效:采用此策略后, across 10个不同的基因组位点,DBL靶向基因组的取向(DBL-binds-genome)比TBL靶向基因组的取向(TBL-binds-genome)平均减少了90.4%的脱靶插入。在最优条件下,实现了高达82%的靶向特异性(SBF2位点)和9.8%的插入效率(ANP32A位点)。
4. 深度突变扫描与蛋白质工程
为了进一步提升ISCro4的活性,研究团队在人类细胞中对其进行了深度突变扫描(Deep Mutational Scanning, DMS),直接筛选在人类细胞环境中更有效的突变体。
筛选方法:在K562细胞中构建了覆盖ISCro4所有氨基酸单点突变的文库,通过报告系统富集高活性突变体,并测序分析其富集情况。
关键发现:
RuvC结构域(催化核心)的突变容忍度最高,而CC结构域(二聚化)和Tnp结构域(bRNA结合)的突变容忍度最低,与其关键功能一致。
发现了多个能提升活性的单点突变,如 S30T, P54Q, S243H。
S243H突变可能通过其侧链与DNA磷酸骨架形成新的氢键,从而增强催化活性。
工程化酶:将S30T, P54Q, S243H组合成三重突变体(ISCro4-TM),该突变体在不同位点的插入效率均比野生型ISCro4 consistently提高了约1.5倍。结合增强型bRNA,最终在SBF2位点实现了20.2%的插入效率。
5. 实现兆碱基尺度的基因组重排
本研究最令人瞩目的成果在于证明了Bridge系统处理巨大基因组片段的能力。
倒转(Inversion)与切除(Excision):通过设计bRNA靶向染色体上两个远距离的位点,ISCro4成功介导了染色体内的倒转和切除。
惊人尺度:
倒转:成功倒转了长达0.92 Mb(929,524 bp)的基因组片段,效率达5.62%。
切除:成功切除了长达0.13 Mb(134,143 bp)的片段,效率达10.8%。
重要的是,编辑效率与距离无关,展现了其处理超大片段的能力。
应用示范:
BCL11A增强子切除:成功切除与镰状细胞贫血治疗相关的BCL11A基因增强子,效率最高达18.7%,为基因治疗提供了概念验证。
弗里德赖希共济失调(Friedreich‘s ataxia)重复序列切除:该疾病由FXN基因内含子中GAA三核苷酸异常重复扩增引起。研究证明,仅使用DBL即可有效切除报告质粒中的重复序列,且倾向于切除更多的重复单元(>80%的重复序列),为治疗此类重复扩展疾病提供了新思路。
三、 总结与展望
这项研究是基因组编辑领域的一个里程碑,其主要贡献和意义如下:
工具突破:成功将Bridge重组酶系统从原核推向了真核人类细胞,并通过系统的分子工程(RNA工程、蛋白质工程)将其效率提升到了具有实用价值的水平(~20%)。
机制创新:深入揭示了其作用机制(如DBL-DBL重组),并提出了DBL靶向基因组这一关键策略,一举解决了早期应用中的特异性难题。
尺度革命:首次实现了对人类基因组兆碱基(Megabase)尺度的可编程、精准、无疤痕的重排(倒转、切除),这是现有任何其他工具都无法轻易实现的。
应用广泛:从基因插入(基因治疗)到大片段倒转/切除(疾病建模、功能基因组学),再到重复序列切除(治疗重复扩展疾病),展示了其极其广阔的应用前景。
未来方向:文章指出,未来的优化将集中于进一步提高靶向效率和特异性、递送大片段DNA有效载荷的能力,以及开发治疗性递送方案(如纯RNA递送)。这项技术有望与AI设计的复杂DNA序列结合,实现前所未有的可编程基因组设计。
总之,这项研究不仅提供了一个强大的新工具,更开辟了一个名为 “可编程基因组重排”的新领域,预计将对基础研究、疾病建模和基因治疗产生深远而持久的影响。