订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com
一、 核心发现:La蛋白是PE的关键细胞决定因子
本研究最核心的发现是:通过全基因组规模的CRISPR干扰(CRISPRi)筛选,研究人员鉴定出 La蛋白(由SSB基因编码)是调控先导编辑效率的最强正调节因子。
筛选方法:研究团队设计了一种巧妙的 FACS报告系统。该系统只有在先导编辑成功引入特定突变(如插入一个起始密码子ATG)时,才会表达绿色荧光蛋白(GFP)。通过分选成功编辑(GFP+)和未成功编辑(GFP-)的细胞群,并分析其中CRISPRi sgRNA的富集情况,可以找出哪些基因的敲低会影响编辑效率。
关键结果:在筛选中,靶向La基因的sgRNA在未编辑细胞(GFP-)中显著富集,这意味着敲低La会严重损害先导编辑的效率,表明La是PE的一个关键促进因子。这一发现在另一个基于细胞表面标记(MCS)的报告系统筛选中得到了验证。
二、 La蛋白的功能与机制:稳定pegRNA
La蛋白是一种广泛表达的真核蛋白,其主要已知功能是结合RNA聚合酶III(Pol III)转录本3'端的聚尿苷酸(polyU)序列,保护它们免受外切核酸酶的降解。
功能验证:
在多种细胞系(K562, HEK293T, HeLa, U2OS)中,通过CRISPRi或siRNA敲低La,均显著降低了PE2、PE3、PE4、PE5等多种编辑策略的效率,对碱基替换、插入、缺失等多种编辑类型均有效。
构建La基因敲除(La-KO)的K562细胞系后,PE效率同样大幅下降,而回补表达La蛋白则可以挽救这一缺陷。
机制阐明:
当pegRNA的3'端polyU尾的最末端尿苷酸保持未修饰(具有2'-OH)时,La蛋白能够结合并发挥保护作用,此时敲低La会显著降低编辑效率。
当polyU尾被化学修饰(如2'-O-甲基化)封闭时,La无法结合,其缺失对编辑效率影响很小。
La蛋白通过其N端结构域(La(1-194))与pegRNA相互作用。该结构域包含La motif和RRM1,负责高亲和力地结合polyU。
研究人员合成了具有不同3'端化学修饰(如2'-O-甲基化)和polyU尾的pegRNA。实验发现:
小RNA测序证实,La的缺失会导致pegRNA和epegRNA的稳定性下降,3'端更容易被降解。
三、 技术创新:开发新型先导编辑器PE7
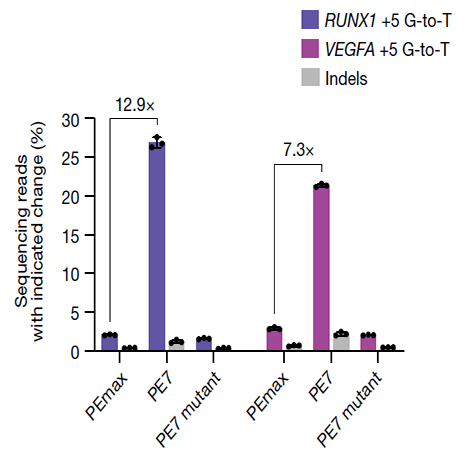
基于上述机制,研究团队将La蛋白的活性N端结构域(La(1-194))与现有的高效先导编辑器 PEmax进行融合,创建了新一代编辑器 PE7。
设计思路:将La(1-194)作为“保护伞”直接拴在编辑器上,使其能够在局部高效地稳定与其共同表达的pegRNA的3'端,而不依赖于细胞内源La蛋白的水平。
卓越性能:
在多种细胞系(U2OS、HeLa、K562)和多个基因组位点上,PE7的编辑效率显著超越PEmax。在U2OS细胞中使用PE2策略时,PE7将编辑效率中位数提高了21.2倍(使用pegRNA)和5.5倍(使用epegRNA)。
PE7与更先进的PE4(抑制MMR)、PE5(抑制MMR+工程化逆转录酶)策略联用时,同样能带来显著的协同增效作用。
安全性良好:实验表明,PE7并未显著增加脱靶编辑、细胞毒性或全转录组的异常变化。
四、 应用拓展:在原代细胞中的成功演示
研究进一步证明了PE7在临床应用相关的原代细胞中同样有效,这是衡量其转化潜力的关键一步。
在人原代T细胞中:通过电转递送PE7 mRNA和带有可接近polyU尾的合成pegRNA,在8个位点实现了中位数为20.0%的编辑效率,比PEmax提高了2.3倍。
在人CD34+造血干/祖细胞(HSPCs)中:PE7在HBB(镰状细胞贫血靶点)和ATP1A1位点分别实现了5.2倍和2倍的效率提升,编辑效率最高达到41.0%。
这些结果证明了PE7在治疗相关细胞类型中具有巨大的应用潜力。
五、 总结与意义
科学发现:本研究首次通过系统性的全基因组筛选,发现内源性RNA结合蛋白La是先导编辑的一个关键细胞学决定因子,并详细阐明了其通过结合并稳定pegRNA的3'polyU尾来发挥功能的分子机制。
技术突破:基于机制研究,成功开发了PE7这一新型先导编辑器。其创新之处在于将RNA保护功能直接整合到编辑器蛋白中,实现了“自给自足”的增效模式,不依赖于外源共表达其他大蛋白(如MLH1dn)。
应用前景:PE7具有高效、通用、安全的特点,并在原代人类细胞中验证成功,为先导编辑技术走向临床治疗(如治疗镰状细胞贫血、遗传性血液疾病等)提供了更强大的工具和更优的解决方案。
方法论贡献:本研究展示了一套完整的“筛选-验证-机制-应用”的研究范式,为未来发现和优化其他基因编辑工具的细胞调控因子提供了蓝图。
总之,这项工作不仅深化了我们对先导编辑与细胞内环境相互作用的理解,更重要的是,它将基础生物学发现转化为了一种切实可用的、更强大的基因编辑工具,推动了整个领域向临床应用迈出坚实的一步。