订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com
可编程基因组插入新纪元:工程化重组酶实现高效、特异的位点特异性DNA整合
本研究开发了一套系统的工程化策略,成功改造了大丝氨酸重组酶(LSRs),使其能够高效、特异性地将长达12 kb的大片段DNA精准插入人类基因组的特定内源位点,无需预安装“着陆垫”,为基因治疗和合成生物学提供了强大的新工具。
研究背景与挑战
精准、高效地将大片段DNA序列整合到基因组特定位点是基因治疗(如CAR-T细胞疗法、遗传病基因矫正)和基础研究(如构建报告基因细胞系、功能基因组筛选)的长期追求。现有技术存在明显局限:
病毒载体系统(如慢病毒):整合随机,有致瘤风险。
CRISPR-Cas系统:依赖DNA双链断裂(DSB),易导致indel等不可控副产物,且大片段插入效率低。
传统重组酶系统(如Cre-LoxP):需要预装“着陆垫”(landing pad),应用繁琐。
大丝氨酸重组酶(LSRs)因其能催化两条DNA链(供体质粒的attP位点与基因组的attB位点)间的直接重组,无需DSB,理论上极具潜力。然而,天然LSRs存在两大瓶颈:
效率低下:在人类细胞中整合效率通常低于5%。
特异性不足:除目标位点(on-target)外,会在全基因组范围内产生大量脱靶(off-target)整合事件。
核心研究策略:多维度协同工程化
研究团队没有采取单一策略,而是开创性地整合了四大工程化模块,对模式LSR——Dn29进行了系统性改造:
定向进化(Directed Evolution):构建了包含1483个Dn29变体的深度突变扫描文库,在细菌中进行功能筛选,初步富集高效且特异的重组酶变体。
机器学习指导的突变叠加(Machine Learning-Guided Mutation Stacking):利用线性回归和梯度提升模型(XGBoost, CatBoost)分析单点突变的功能数据,成功预测多点突变叠加效应,理性组合出最优变体。
dCas9融合招募策略(dCas9 Fusion for Recruitment):将催化失活的dCas9与LSR融合,并通过sgRNA将其精准招募到目标基因组位点附近,极大提高了局部浓度和整合效率。
供体DNA优化(Donor DNA Optimization):系统筛选并优化了供体质粒上的attP序列,发现了比野生型序列更高效的工程化attP(e-attP)。
关键成果:三款高性能工程化重组酶
通过上述多维策略的组合优化,团队最终获得了三款性能卓越的工程化重组酶:
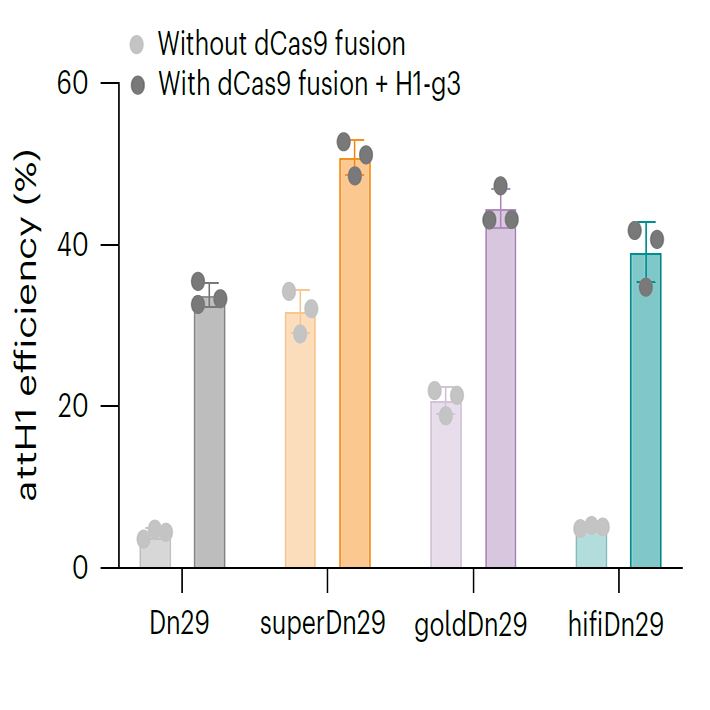
superDn29: 高效变体。在内源位点(attH1)的整合效率相比野生型(WT)提升10倍,但脱靶效应也较高。
goldDn29: 平衡变体。整合效率提升4倍,同时全基因组特异性提升44倍,实现了效率与特异性的良好平衡。
hifiDn29: 高保真变体。在保持WT水平整合效率的同时,将全基因组特异性推向了检测极限(97%),几乎完全消除了脱靶整合。
这些变体与dCas9融合后,性能得到进一步飞跃。例如,goldDn29-dCas9和 hifiDn29-dCas9在人体细胞中实现了 40-53%的整合效率,同时将全基因组特异性提升至 91-97%。
机制探索与理性设计
研究不仅停留在表型筛选,更深入揭示了功能增强的分子机制:
效率突变热点:发现位于 coiled-coil 铰链区的多个突变(如 L388P, Q390P)通过破坏螺旋二级结构,可能通过调节四聚体稳定化或自抑制控制来增强活性。
特异性突变机制:许多关键特异性突变(如 N341K)位于DNA结合界面附近,将中性氨基酸替换为带正电的残基(如赖氨酸、精氨酸), likely通过增强与DNA磷酸骨架的相互作用来提高结合特异性。
协同效应:发现大部分突变效应是叠加性(additive)的,而非协同或抗拮,这为机器学习模型的成功预测奠定了基础。
应用展示:从体外细胞到原发性T细胞
团队在多种具有挑战性的细胞类型中验证了这些工程化重组酶的强大性能:
非分裂细胞:在细胞周期被抑制的细胞中,工程化LSR仍能保持高效的整合能力,证明了其不依赖细胞分裂的特性。
人多能干细胞(hESCs/iPSCs):成功将12 kb的CRISPRi(CRISPR干扰)系统精准整合到attH1位点,效率高达24.5%。分化后的造血祖细胞(HPCs)仍能稳定表达 cargo 基因,并有效 knockdown 细胞表面标志物(如CD81, CD147)。
原代人类T细胞:通过电转mRNA或AAV递送,成功在原发性T细胞中整合了5.8 kb的CD19 CAR表达框,效率最高达11%。编辑后的CAR-T细胞在体外能有效杀伤白血病靶细胞(Nalm6)。
安全性评估:卓越的安全性特征
基因编辑工具的安全性是临床转化的核心。全面评估显示:
DNA损伤响应(DDR)低:特异性增强变体(goldDn29, hifiDn29)诱导的γ-H2AX(DNA双链断裂标志物)水平与背景相当,甚至低于公认高保真的Bxb1重组酶。
细胞毒性低:编辑后细胞活力未受显著影响。
基因组重排罕见:全基因组测序检测到的染色体间易位等重大重排事件发生率极低(0-0.3%)。
转录组扰动小:RNA-seq分析显示,与Cas9在AAVS1等安全港编辑相比,hifiDn29-dCas9编辑引起的差异表达基因(DEGs)数量最少,且未扰乱癌基因、抑癌基因或必需基因。
研究意义与前景
这项研究代表了基因组编辑领域的一个重大突破:
方法论创新:建立了“AI预测-定向进化-理性设计-功能验证”的蛋白质工程全新范式,可推广至其他工具酶的开发。
技术工具革新:提供了高效、特异、安全的“一站式”大片段DNA插入解决方案,克服了现有技术的诸多瓶颈。
临床应用潜力巨大:
为CAR-T细胞疗法提供了更安全、高效的基因整合方案。
为遗传病治疗提供了“一次治疗,终身治愈”的可能性,例如无需针对特定突变,而是直接插入一个完整的健康基因拷贝。
为基础研究提供了构建高质量报告细胞系、进行复杂遗传回路筛选的强大工具。
跨物种兼容性:研究表明工程化Dn29能识别小鼠、猕猴等多种模式生物中的同源序列,为临床前研究铺平了道路。
总之,这项工作不仅开发了性能卓越的新一代基因组编辑工具,更展示了一套行之有效的蛋白质工程路线图,极大地推动了基因治疗和合成生物学领域的发展。