订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com

突破百年局限!AI设计“智能胰岛素”问世,精准调控血糖且不促癌
这项发表于《Molecular Cell》的突破性研究,利用人工智能蛋白质设计技术,成功开发出新一代胰岛素受体激动剂。这些新型合成分子不仅比天然胰岛素更有效,还能精准调控不同的信号通路,在高效降低血糖的同时,显著降低了促进癌症的风险,为糖尿病治疗带来了革命性进展。
研究背景与挑战
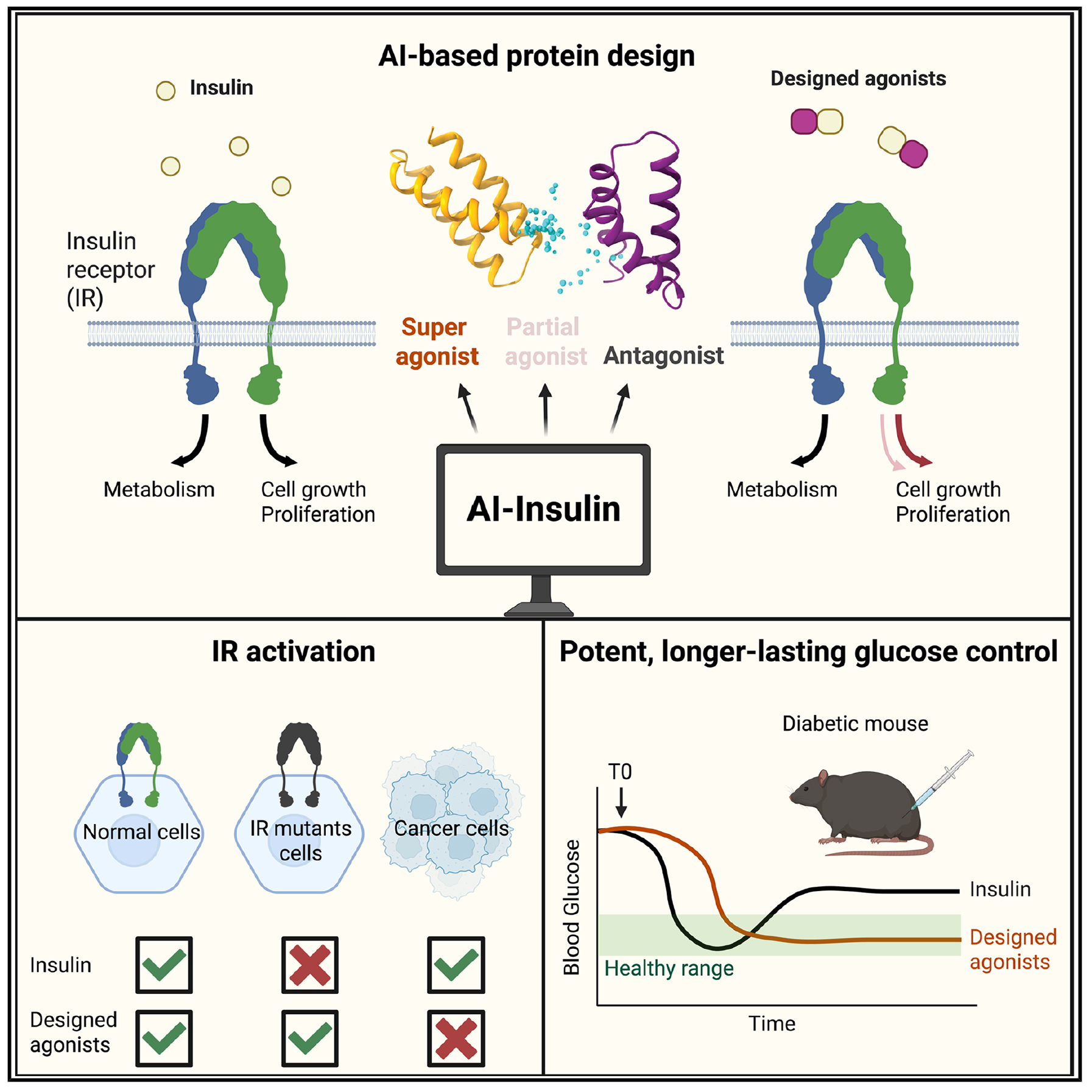
胰岛素自1921年发现以来,一直是糖尿病治疗的基石药物,但其应用存在明显局限。它会同时激活胰岛素受体(IR)下游的AKT(调控代谢)和MAPK(调控增殖)两条信号通路,后者可能带来促进细胞增殖和增加癌症风险的问题。此外,天然胰岛素对某些胰岛素受体突变无效,无法治疗一些罕见的胰岛素抵抗综合征,其本身较差的稳定性也为储存和运输带来了挑战。
创新的AI驱动设计策略
研究团队采用了一种全新的理性设计方法。首先,他们分别设计了能够特异性结合胰岛素受体两个关键部位(L1结构域和F1结构域)的迷你蛋白S1B和S2B。其中,S2B的结合亲和力高达1.9 nM,远优于胰岛素的21 μM。
随后,他们通过不同的连接策略将S1B和S2B融合,构建出完整的受体激动剂。这其中包含了使用柔性连接链的构建体(允许结构域相对运动)和使用刚性螺旋连接的构建体(固定结构域的相对取向),旨在探索不同构象对信号输出的影响。
卓越的性能表现
实验结果表明,这些设计的激动剂性能卓越。刚性连接的激动剂(如RF-405和RF-409)作为完全激动剂,能像胰岛素一样有效激活AKT和MAPK通路。而柔性连接的激动剂(如S2-F1-S1)则表现出“偏向性激动”的特性,主要激活AKT通路,对MAPK通路的激活能力仅为胰岛素的40%。更有趣的是,其中一种构建体(S1-F8-S2)甚至可以作为胰岛素的拮抗剂。
在治疗效能上,设计的激动剂展现出巨大优势。RF-409在用量仅为胰岛素一半时,降糖效果就与之相当,且单次注射后可维持血糖稳定长达6小时,而胰岛素通常只能维持2小时。此外,这些合成蛋白具有超高的热稳定性,在95°C下仍能保持结构完整,彻底解决了胰岛素稳定性难题。
显著的安全性突破
安全性是本研究最引人注目的突破之一。在乳腺癌细胞MCF7中,胰岛素会强烈激活IR及其下游信号,而设计的刚性激动剂RF-405几乎不激活这些信号,并且不促进癌细胞的增殖。进一步研究发现,RF-405不能激活IR与IGF1R(胰岛素样生长因子1受体)形成的杂合受体,而癌细胞表面往往存在较多此类杂合受体。这一特性巧妙地解释了为何设计激动剂能选择性激活正常细胞而非癌细胞,从而潜在降低了致癌风险。
治疗范围的扩展
设计的激动剂还成功攻克了传统胰岛素的另一个短板——对受体突变无效。它们能够有效激活多种导致罕见疾病(如Donohue综合征和Rabson-Mendenhall综合征)的胰岛素受体突变体,为这些以往难以治疗的遗传病患者带来了新的希望。
结构生物学验证
研究人员通过冷冻电镜技术解析了设计激动剂与胰岛素受体的复合物结构。结构显示,这些激动剂确实诱导受体形成了类似的T形活性构象。刚性连接激动剂形成的复合物结构更为有序,而柔性连接激动剂的复合物则显示出更高的动态性,这从结构层面解释了其产生不同信号偏向性的分子基础。
研究意义与未来展望
这项研究具有重大的科学价值和临床应用前景。在科学上,它首次实现了对受体信号通路的精准调控,为G蛋白偶联受体(GPCR)等其他重要受体家族的药物设计提供了全新范式。在临床上,它预示着更安全的糖尿病治疗、罕见胰岛素抵抗综合征的治疗突破,以及更简便的药物存储运输流程。
这项成果标志着蛋白质设计药物开发进入了新时代,不仅为糖尿病治疗带来了突破性工具,也为整个靶向药物研发领域提供了全新的思路和强大的技术平台。











