订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com

基因编辑新利器:常温高效工作的CpAgo实现高精度双链DNA切割
中国科学家解析其依赖二聚化与新型PAZ口袋的激活机制,为基因组编辑注入新动能
研究背景与核心问题
Argonaute (Ago) 蛋白是存在于真核生物和原核生物中的关键核酸酶。真核Ago (eAgos) 通过小干扰RNA (siRNA) 或 microRNA (miRNA) 进行RNA干扰的机制已被广泛研究。然而,原核Ago (pAgos) 在细菌防御中的工作机制,特别是在常温(中温)条件下,仍未被充分探索。
此前已知的许多pAgos(如TtAgo)是嗜热的,需要在高温(~65°C)下才能发挥最佳活性,这限制了其在生理相关条件下的研究和应用。虽然近期发现了一些中温pAgos(如CbAgo, LrAgo),但它们的催化效率相对较低。因此,发现并阐明一种在37°C下具有高效活性的中温pAgo的分子机制,对于理解原核免疫和开发新型生物技术工具至关重要。
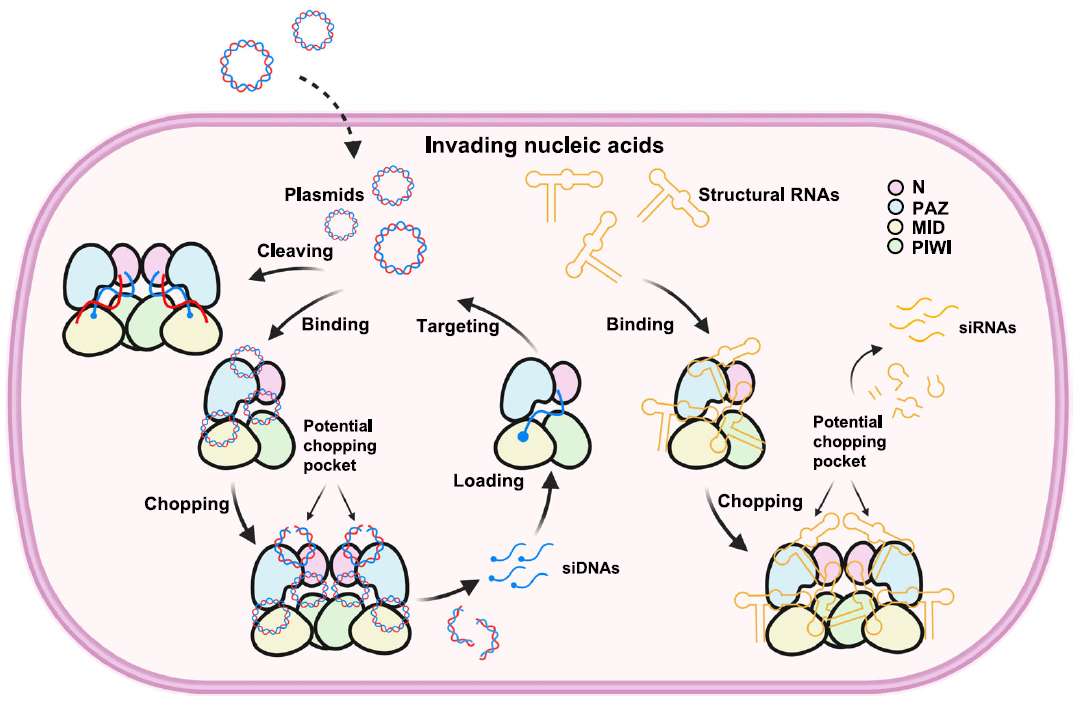
核心发现:CpAgo的双重催化活性与高效性
本研究聚焦于来自产气荚膜梭菌的CpAgo,并揭示了其独特的催化能力:
不依赖引导链的催化活性 (Guide-independent activity):
CpAgo在没有引导DNA (gDNA)的情况下,能高效地将质粒DNA和结构化的RNA(如SL5 RNA)降解成小片段。对于质粒DNA,它能在30分钟内将其完全降解为约21个核苷酸的产物。这种活性不依赖于PIWI结构域中经典的DEDX催化四联体,因为催化失活突变体(D614A)仍保留此功能。
DNA引导的靶向切割活性 (DNA-guided cleavage activity):
CpAgo能利用短链单链DNA (ssDNA) 作为引导链,在37°C下特异性切割与引导链互补的单链DNA (ssDNA) 和双链DNA (dsDNA)。对于dsDNA的切割,需要目标区域存在部分解链(如“气泡”结构)。
与另一种中温pAgo (IbAgo) 相比,CpAgo在上述两种活性上都表现出显著更高的催化效率,使其成为研究pAgo功能的理想模型。
分子机制:结构生物学揭示的全新见解
通过冷冻电镜 (cryo-EM) 技术,研究人员解析了CpAgo与核酸复合物的高分辨率结构,揭示了其独特工作机制的关键要素:
PAZ结构域中的新型核苷酸结合口袋:
在CpAgo的PAZ结构域中发现了一个富含正电荷氨基酸的核苷酸结合口袋。该口袋对于引导链依赖性和非依赖性的底物识别与切割都至关重要。突变该口袋中的关键氨基酸(如K50, R246等)会严重破坏CpAgo的切割活性和底物特异性。
二聚化是催化活性的先决条件:
结构分析表明,CpAgo的二聚化是其发挥催化功能所必需的。无论是引导链依赖的靶向切割,还是引导链非依赖的核酸降解,都需要形成二聚体。
活性形式: 与引导链和目标DNA结合后形成的二聚体是催化活性状态。
非活性形式: 仅与引导链结合的单体状态是催化失活的。
激活机制: 目标DNA的结合诱导了从单体到二聚体的构象变化,使PIWI结构域中的催化残基(如D544)精确定位到切割位点,从而激活酶活性。
引导链非依赖活性的催化中心:
研究发现,PAZ结构域中的D80和D249是引导链非依赖的核酸降解活性的关键催化残基。这与PIWI结构域中的经典催化中心(DEDX)是分开的,解释了为什么PIWI的催化突变体(D614A)仍能降解质粒。
生物学功能验证:细菌细胞内的防御作用
研究在大肠杆菌中验证了CpAgo的生物学功能:
引导链非依赖的质粒清除: 表达野生型CpAgo能显著降低细菌细胞中外来质粒的保有量,而PAZ口袋关键残基的突变(D80A, D249A)则削弱了这一效应。
DNA引导的DNA干扰: 通过双质粒干扰实验证实,CpAgo能在细胞内进行引导DNA依赖的靶向切割,有效干扰目标质粒的存活。
基于这些发现,研究者提出了一个CpAgo介导的原核防御模型:CpAgo通过其引导链非依赖的活性降解外来核酸(如噬菌体DNA),产生短的DNA片段;这些片段随后可作为引导链,通过引导链依赖的途径进一步靶向和清除入侵的遗传物质。
研究意义与前景
理论意义: 本研究深入揭示了中温pAgo CpAgo的双重催化机制、独特的PAZ口袋功能以及二聚化激活模式,极大地增进了我们对pAgo介导的原核免疫系统的理解。
技术潜力: CpAgo在37°C下的高效活性,特别是其切割dsDNA的能力,使其成为基因组编辑和分子诊断等领域一个有巨大潜力的新型工具。其引导链非依赖的“非特异性”核酸降解活性也可能在抗菌或抗病毒应用中发挥作用。
总结: 这项工作系统地表征了CpAgo作为一种高效、多功能的中温pAgo,通过结构生物学和功能实验阐明了其依赖于新型PAZ口袋和二聚化的独特工作机制,不仅深化了基础科学认知,也为未来的生物技术应用开辟了新道路。