订购/支持:theta_gene@163.com
公司网址:https://www.theta-gene.com

本研究针对热固性聚氨酯乙二醇解回收中下游芳香族氨基甲酸酯副产品生物水解的瓶颈,开发了GRASE框架。该框架通过Pythia-Pocket模型对活性位点残基进行高维结构嵌入以预测功能,并结合Pythia模型评估蛋白质折叠稳定性。成功发现了活性较已知酶提升两个数量级、且在6 M二甘醇(DEG)中保持稳定的新型脲烷酶AbPURase,并完成了千克级的聚氨酯泡沫近完全解聚验证,为工业酶的高效理性设计提供了新范式。
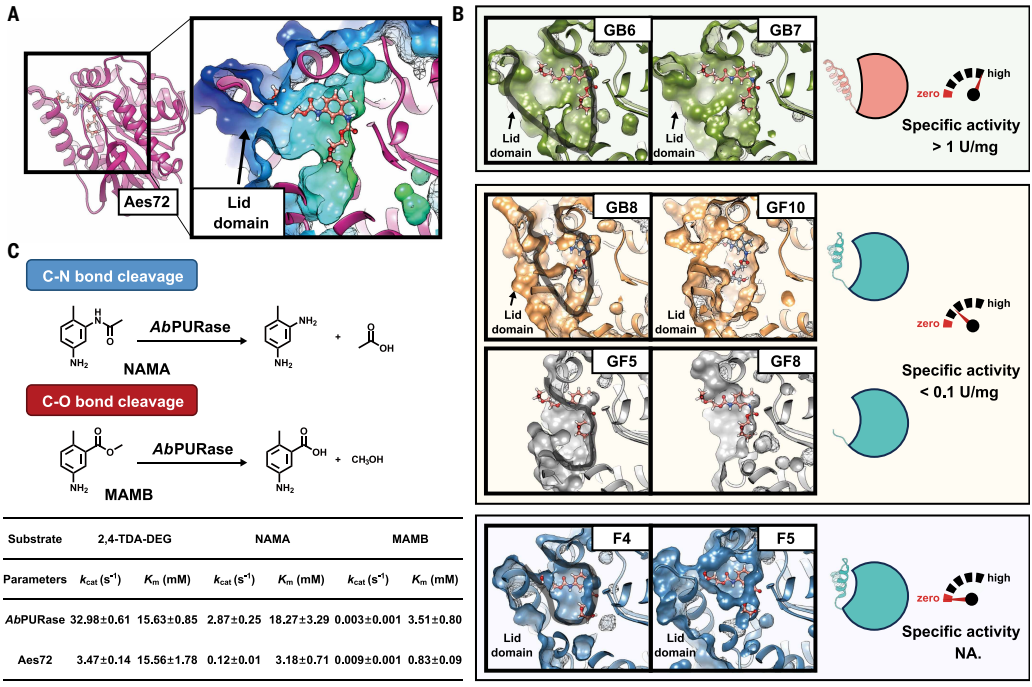
一、 卓越的催化性能:活性与稳定性的双重飞跃
与先前报道的脲烷酶(如Aes72和SP1)相比,AbPURase在关键指标上实现了数量级的提升。
超高效水解活性:
在对乙二醇解主要产物2,4-TDA-DEG的水解中,AbPURase的比活性高达 2.14 U/mg,是基准酶Aes72(0.06 U/mg)的 35倍以上。
对于2,6-TDA-DEG,其活性也达到0.94 U/mg,相较于Aes72提升了约 62倍。
颠覆性的溶剂兼容性:
最为关键的是,AbPURase在接近工业实际的高浓度二甘醇(DEG)环境中仍能保持极高活性。在 6 M DEG的苛刻条件下,其在50°C时的活性比Aes72高出 465倍。
这种在极端溶剂条件下保持高活性的特性,是其能够与上游乙二醇解工艺无缝集成的根本原因。
二、 强大的工业级应用验证:从克级到千克级的成功放大
AbPURase的价值在其千克级规模的验证中得到充分体现。
高效的公斤级解聚:
对1公斤商业BASF聚氨酯泡沫进行乙二醇解后,使用AbPURase处理底相。在 50°C、酶负载量8-16 mg/g的条件下,仅需 8小时即可实现底相中TDA-DEG的 98.6%转化。
该过程成功释放出约385 mM的TDA单体,并通过精馏实现了 94.7%的TDA回收率和 98.5%的DEG回收率。
优异的操作稳定性:
即使在未进行固定化处理的情况下,AbPURase也展现出良好的可重复使用性,能够连续进行至少三个反应周期并保持近完全的转化效率,这极大地降低了潜在的应用成本。
三、 独特的结构特征:高活性与高稳定性的分子基础
结构分析揭示了AbPURase卓越性能的结构根源。
开放的活性位点架构:
与天然模板Aes72相比,AbPURase的活性位点入口更为开放,形成一个V形的盖结构域(Lid Domain)。这种结构为大体积的芳香族氨基甲酸酯底物(如TDA-DEG)的进入和结合提供了充足的空间,是其高效催化的结构前提。
卓越溶剂稳定性的关键机制:
紧密的疏水核心:其盖结构域由一个由M38与I9, M12, L13, F197, W271等多个残基形成的紧密疏水核心所稳定,这有效阻止了高浓度DEG溶剂的渗透和破坏。
脯氨酸稳定的刚性环:连接盖结构域的环区含有多个脯氨酸残基(P24, P25, P27),这为该区域提供了显著的刚性,增强了其在恶劣环境下的结构保持能力。
相比之下,Aes72的对应区域疏水核心作用较弱且脯氨酸含量少,导致其在6 M DEG中发生显著的结构去稳定化(Tm下降15°C)。
四、 催化功能注释:本质为高效的酰胺酶
动力学表征发现,尽管被注释为羧酸酯水解酶(EC 3.1.1),但AbPURase对酰胺键(NAMA)的水解活性比其对酯键(MAMB)的活性高出三个数量级。这表明,其高效水解氨基甲酸酯键(兼具酯和酰胺特性)的能力,主要源于其强大的内在酰胺酶活性。这为理解其催化机制和后续工程改造提供了重要方向。
总结与展望
AbPURase的发现,首次提供了一个真正具备工业应用潜力的聚氨酯生物回收工具酶。其“即插即用”的特性,使得将生物催化步骤直接整合进现有的聚氨酯乙二醇解工业流程成为可能,为实现聚氨酯的绿色循环经济扫除了一个关键障碍。
未来工作可集中于:
蛋白质工程优化:基于其结构,进一步改善其催化效率或底物谱。
下游工艺整合:优化回收单体TDA再转化为TDI的工艺,实现真正闭环。
机制深入研究:阐明其高效酰胺酶活性的精确催化机制。
AbPURase不仅是酶学应用的一项杰出成就,也为解决其他顽固高分子废弃物的生物回收难题树立了标杆。











